 Rf=distance composant/distance éluant
Rf=distance composant/distance éluant CHROMATOGRAPHIE SUR COUCHE MINCE
______________
PRESENTATION
Ce texte présente deux manipulations de chromatographie sur couche mince (CCM), l'une utilisée en option sciences expérimentales de première S et l'autre en terminale S.
Il comporte trois parties :
Un rappel sur le principe de la chromatographie sur couche mince qui peut être distribué aux élèves en début de séance.
2░ Partie : CHROMATOGRAPHIE DES COLORANTS D'UNE FEUILLE DE PRUNUS.
L'extraction et la chromatographie des colorants d'une feuille de Prunus. Cette manipulation a été mise au point en coopération avec Monsieur MAURY, professeur de biologie au Lycée de Ribérac.
3░ Partie : CHROMATOGRAPHIE DES HUILES ESSENTIELLES DE MENTHE POIVREE.
L'extraction et la chromatographie d'huiles essentielles de feuilles Menthe poivrée. Cette manipulation est due en grande partie à l'assistance amicale du Docteur CARNAT, de la Faculté de pharmacie de Clermont-Ferrand.
Chaque manipulation est accompagnée de la liste du matériel nécessaire, d'un bref résumé des résultats que l'on peut obtenir et de quelques conseils pour la mise au point de la manipulation.
1░ Partie :
CHROMATOGRAPHIE.C'est à la fois une technique de séparation et d'analyse.
a) Principe.
Certaines molécules peuvent se fixer momentanément à la surface de particules solides : c'est le phénomène d'adsorbance ; le solide est appelé adsorbant. Lorsqu'on fait circuler ces molécules à travers un adsorbant, leur vitesse de déplacement est d'autant plus faible que l'adsorbance est plus forte : des molécules d'adsorbances différentes vont donc se déplacer à des vitesses différentes et vont ainsi pouvoir être séparées. Les molécules sont entraînées par un gaz ou un liquide appelé éluant. La vitesse d'entraînement des molécules dépend aussi de leur affinité avec l'éluant. La vitesse de déplacement des particules dépend donc de l'adsorbant et de l'éluant.
b) Différents types de chromatographies.
On classe les différentes chromatographies après le type d'adsorbant et le type d'éluant.
- gazeux : chromatographie en phase gazeuse
- couche mince : une couche mince d'alumine ou de silice est déposée sur un support de polyester, de mylar, d'aluminium ou de verre. (éluant liquide )
- colonne : un long tube fin est rempli d'un adsorbant en poudre ; l'éluant peut être un gaz ou un liquide.
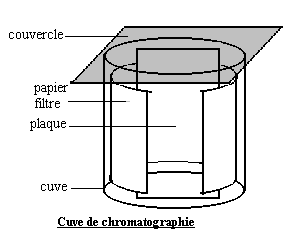
c) Chromatographie sur couche mince ( CCM ).
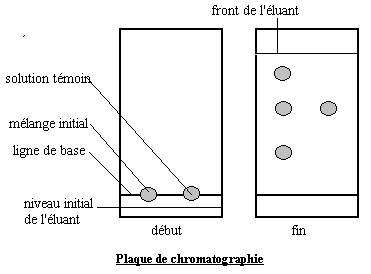
On utilise un récipient haut (par exemple un becher) appelé " cuve " au fond duquel on verse une faible quantité d'éluant. On place contre les bords de la cuve un morceau de papier filtre : l'éluant va monter par capillarité et assurera ainsi une meilleure saturation de la cuve. La saturation est nécessaire pour éviter l'évaporation de l'éluant pendant son ascension le long de la plaque. Sur une " plaque " constituée d'un support sur lequel est déposé l'adsorbant, adapté à la dimension de la cuve, on dépose une micro-goutte du corps à étudier et éventuellement des réactifs de référence. L'éluant monte par capillarité dans l'adsorbant, entraînant les différents composants à des vitesses différentes. On laisse l'éluant monter jusqu'à proximité du haut de la plaque.
Chaque composant est caractérisé par son " rapport frontal " noté Rf : c'est le rapport entre la distance parcourue par le composant et la distance parcourue par l'éluant en fin d'expérience.

 Rf=distance composant/distance éluant
Rf=distance composant/distance éluant
MANIPULATION
1-OBJECTIF.
On veut réaliser la chromatographie des colorants contenus dans des feuilles de Prunus.
2-PREPARATION DES CUVES A CHROMATOGRAPHIE.
On dispose de deux cuves de chromatographie et de deux éluants.
a)Verser dans une cuve (becher ou "pot de blédine") 1 à 2ml de méthanol qui sera utilisé comme éluant ; le liquide doit recouvrir le fond de la cuve et ne pas dépasser une hauteur de 5mm. Placer ensuite un "verre de montre" ou un couvercle sur la cuve pour que l'air contenu soit saturé en méthanol, et éviter l'évaporation. Repérer la cuve.
b)Préparer dans les mêmes conditions l'autre cuve avec l'autre éluant. Repérer la cuve.
3-EXTRACTION DES COLORANTS.
a)Placer 4 feuilles de Prunus dans le mortier contenant environ 5ml de méthanol, utilisé comme solvant. Avec le pilon, écraser soigneusement les feuilles dans le solvant de manière à extraire totalement les colorants.
b)Filtrer le mélange obtenu dans le mortier et recueillir le filtrat dans un verre à pied.
4-PREPARATION DES PLAQUES DE CHROMATOGRAPHIE.
a)A 1cm de l'un des petits côtés de chaque plaque marquer un trait fin au crayon (ligne de base). ATTENTION : NE PAS APPUYER POUR CONSERVER INTACT L'ADSORBANT.
b)Plonger délicatement une pipette pasteur dans le filtrat et en déposer par capillarité une goutte au milieu du trait précédemment marqué. Laisser sécher la plaque et recommencer 4 ou 5 fois de manière que la quantité de colorant soit suffisante. ATTENTION : LA TACHE DE COLORANT NE DOIT PAS DEPASSER 2 A 3 MILLIMETRES DE DIAMETRE.
c)Procéder de même pour la seconde plaque.
5-REALISATION DES CHROMATOGRAPHIES.
a)Placer dans chaque cuve une plaque de chromatographie. Attention à ne pas mettre les bords latéraux de la plaque en contact avec la cuve : l'éluant monterait inégalement le long de celle-ci. Couvrir chaque cuve pour éviter l'évaporation de l'éluant. NE PLUS DEPLACER LA CUVE JUSQU'A LA FIN DE L'ELUTION.
b)Observer la montée de l'éluant sur la plaque et le déplacement des différents colorants.
c)Sortir la plaque de la cuve lorsque l'éluant arrive à environ 1cm du haut de la plaque.
d)Marquer rapidement au crayon le front du solvant (le méthanol s'évapore très vite). Laisser sécher la plaque puis repérer les fronts des différents colorants. Calculer les rapports frontaux Rf des différents colorants pour chaque plaque et donner votre conclusion quant à l'utilisation des deux éluants. Faire les schémas de l'ensemble des manipulations.
6-COLORANTS ET ACIDITE.
a)Récupérer une goutte d'ammoniaque au bout d'un agitateur et le placer sous le papier ayant servi à filtrer la solution de colorants, au niveau ou apparaissent les couleurs. Que constatez-vous ? Notez vos observations.
b)A l'aide d'une pipette, verser une goutte d'acide chlorhydrique sur le papier filtre, à l'endroit ou l'ammoniaque à apportée une modification. Que constatez-vous ? Notez vos observations.
c)Faire les schémas de ces deux expériences et donner vos conclusions.
LISTE DU MATERIEL
: par groupe de travaux pratiques.
RESULTATS.
 La figure ci-dessous est la copie d'une CCM avec support polyester ; l'éluant est le méthanol. Les couleurs ainsi que la ligne de base et les fronts ont été renforcés pour plus de clarté. Mais l'image est conforme au résultat réel, en aspect et en dimensions. Les rapports frontaux, calculés à partir de la plaque, sont les suivants :
La figure ci-dessous est la copie d'une CCM avec support polyester ; l'éluant est le méthanol. Les couleurs ainsi que la ligne de base et les fronts ont été renforcés pour plus de clarté. Mais l'image est conforme au résultat réel, en aspect et en dimensions. Les rapports frontaux, calculés à partir de la plaque, sont les suivants :
|
Nature des colorants |
Couleur |
Rapport frontal |
|
Carotènes |
Jaunâtre |
0,45 |
|
Chlorophylles |
Vert |
0,48 |
|
Xanthophyles |
Jaune |
0,51 |
|
Anthocyanes |
Violet |
0,85 |
Ces résultats ne doivent être considérés qu'à titre indicatif, car le repérage des fronts manque de précision.
La seconde chromatographie présente peut d'intérêt au niveau du calcul des rapports frontaux, car les différentes familles de colorant sont plus étalées et
se chevauchent. Mais il s'agit d'un éluant classique en biologie ; d'autre part, il permet de montrer l'influence de l'éluant sur la vitesse d'élution et la séparation des constituants.
.
CONSEILS DE MANIPULATION.
CHROMATOGRAPHIE DES HUILES ESSENTIELLES DE MENTHE POIVREE.
1 - EXTRACTION.
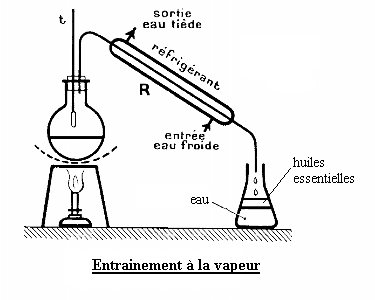
L'extraction d'huiles essentielles est effectuée par entraînement à la vapeur (ou hydrodistillation). Le dispositif est schématisé ci-contre. La matière de base (feuilles, fleurs ou écorces) est hachée puis mélangée avec de l'eau. Le mélange est chauffé et la vapeur d'eau entraîne les huiles essentielles (non solubles dans l'eau). Après refroidissement, le distillat contient deux phases bien séparées : l'eau et la phase organique (les huiles essentielles). Les deux phases peuvent être séparées à l'aide d'une ampoule à décanter.
2 - CHROMATOGRAPHIE DES HUILES ESSENTIELLES.
On réalise une chromatographie sur couche mince pour séparer et identifier les huiles essentielles précédemment extraites.
Faire les schémas des différentes manipulations.
LISTE DU MATERIEL
- par groupe de travaux pratiques :
CONSEILS DE MANIPULATION.
![]()
GOUYON Pierre Lycée Arnaud Daniel RIBERAC