TP- Etude expérimentale de la cinétique de la réaction
des ions iodure I- avec l'eau oxygénée H2O2
Par Denis Gauthier, Lycée Bernard Palissy, 47000 Agen
1- Détermination de la composition instantanée du mélange réactionnel :
1-1 Principe :
* Cette réaction met en présence l'oxydant le plus fort H2O2 et le réducteur le plus fort I- de deux couples, H2O2 / H2O (1,77 V) et I2 / I- (0,62 V) :
réduction de l'oxydant le plus fort H2O2 + 2 H+ + 2 e- ® 2 H2O
oxydation du réducteur le plus fort 2 I- ® I2 + 2 e-
oxydo-réduction bilan (I) H2O2 + 2 H+ + 2 I- ® 2 H2O + I2
* A t = 0, on mélange : 30 mL d'une solution KI à 2,50 x 10-1 mol.L-1 {{M(KI) = 166 g.mol-1 et un titre t(KI) = 41,5 g.L-1} et 30 mL d'une solution H2O2 à c(H2O2) " 4,00 x 10-2 mol.L-1 {4,1 mL H2O2 à 110 volumes dans une fiole jaugée 1 L} additionné de 1,0 mL d'une solution H2SO4 à 3,00 mol.L-1.
* A différentes dates t > 0, on détermine [I2] en dosant la quantité de matière n(I2) formée par iodomètrie avec une solution de thiosulfate de sodium à c(Na2S2O3) = 1,00 x 10-2 mol.L-1 {M(Na2S2O3, 5 H2O) = 248 g.mol-1 et un titre t(Na2S2O3, 5 H2O) = 2,48 g.L-1} suivant la réaction déjà utilisée pour doser I2 libérée par la solution de Bétadine :
oxydo-réduction bilan (II) I2 + 2 S2O32- ® 2 I- + S4O62- (ion tétrathionate)
A l'équivalence d'oxydo-réduction, indiquée par la disparition de la couleur bleue sombre due à I2 et révélée par l'empois d'amidon (indicateur de fin de réaction), le rapport des quantités de matière est dans les conditions stoechiométriques :
n(I2) / n (S2O32-) = 1 / 2
n(I2) = n(S2O32-) / 2 = (c(S2O32-) x V(S2O32-)équivalence) / 2
1-2 Protocole expérimental :
Le pot bleu contient 30 mL de la solution KI ; le pot rouge, 30 mL de la solution H2O2 + 1 mL de la solution H2SO4 ; le verre à pied, la solution Na2S2O3.
- Placer la solution Na2S2O3.dans la burette 50 mL de droite et faire la mise au zéro.
- A t = 0 dans un bécher 250 mL, faire le mélange des deux réactifs, en déclenchant le chronomètre que l'on n'arrêtera plus, et remuer avec l'agitateur en verre.
- Placer le mélange réactionnel dans la burette 50 mL de gauche et faire la mise au zéro.
- Pour doser à une date t > 0 : prélever, à (t - 30 s) (environ), V0 = 5 mL du mélange réactionnel dans un bécher 50 mL ; et préparer à peu près 40 mL d'eau glacée.
- A cette date t > 0, bloquer la réaction en ajoutant sur les 5 mL du mélange les 40 mL d'eau glacée (blocage par dilution et refroidissement).
- Faire couler dedans la solution Na2S2O3 (burette de droite) et, quand le mélange devient jaune clair, ajouter une goutte d'empois d'amidon. Continuer à verser jusqu'à disparition complète de la couleur bleue sombre apparue et relever V(S2O32-)équi.
1-3 Mesures :
* Avec les valeurs utilisées, un volume V0 = 5 mL du mélange réactionnel contient, à l'instant t, les quantités de matière suivantes :
- pour le produit I2,
n(I2) = (10-2 x V(S2O32-)équi en L) / 2 (en mol)
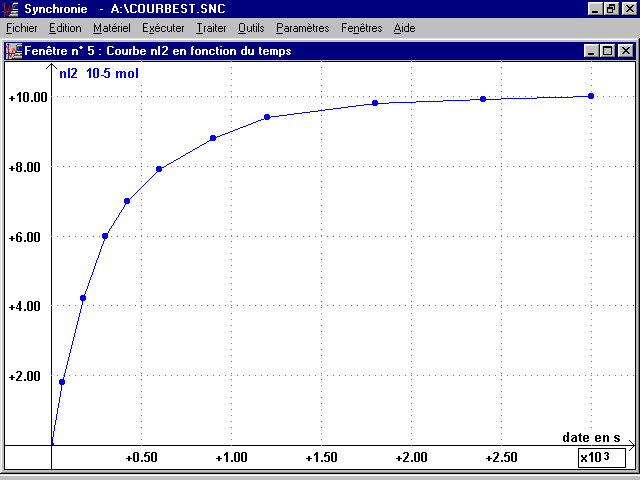
n(I2) = (V(S2O32-)équi en mL / 2) (en 10-5 mol)
- pour le réactif H2O2, puisqu'il disparaît autant de moles H2O2 qu'il apparaît de moles I2,
n(H2O2) = n (H2O2)0 - n(I2)
La quantité initiale n(H2O2)0 n'est pas connue de façon très précise en utilisant c(H2O2) (vieillissement des solutions H2O2) ; elle sera donnée à la fin, la réaction (I) totale étant terminée, par la quantité finale n(I2)f et on calculera alors
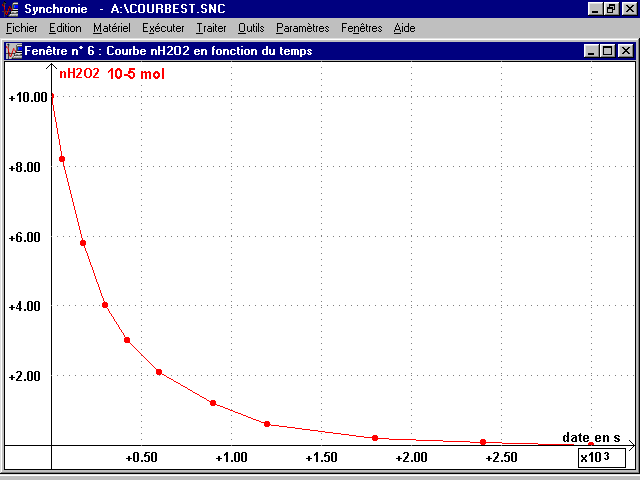
n(H2O2) = n(I2)f - n(I2) (en 10-5 mol)
* Tableau :
Prendre pour les dix dates t, les valeurs suivantes en minutes, 1 3 5 7 10 15 20 30 40 50 ; ces valeurs, à marquer dans le tableau, pourront-être légèrement modifiées, si on n'est pas prêt à cet instant.
|
t (min) |
0 |
|
|
|
|
|
|
|
|
|
|
|
t (s) |
|
|
|
|
|
|
|
|
|
|
|
|
(V(S2O32-)équi (mL) |
0 |
|
|
|
|
|
|
|
|
|
|
|
n(I2) (10-5 mol) |
0 |
|
|
|
|
|
|
|
|
|
|
|
n(H2O2) (10-5 mol) |
|
|
|
|
|
|
|
|
|
|
|
2- Tracé des courbes n(I2)(t) et n(H2O2)(t) :
* A partir des valeurs précédentes, tracer chaque courbe sur une feuille de papier millimétré différente (à porter pour la séance de TP), échelle conseillée :
en abscisse (plus grande dimension de la feuille), 1 cm représente 150 s
en ordonnée, 1,5 cm représente 10-5 mol
* Ces courbes seront aussi tracées à l'ordinateur en utilisant le tableur du logiciel d'acquisition SYNCHRONIE.

_________________________________________________________
© Administrateur Sciences-Physiques. Contact :
Alain.Choyeau@ac-bordeaux.fr© Rectorat de Bordeaux. Contact :
CATICE@ac-bordeaux.fr