
Etude cinétique de la réaction autocatalytique, MnO4- + H2C2O4
en milieu acide, avec un spectrophotomètre et un ordinateur
Par Denis Gauthier, Lycée Bernard Palissy, 47000 Agen
1- Conditions de la réaction :
* Les valeurs choisies pour la concentration des réactifs respectent les contraintes suivantes :
* On réalise le mélange réactionnel suivant:
1 mL de solution H2SO4 à 1,0 mol.L-1
1,5 mL de solution H2C2O4 à 5,0 x 10-3 mol.L-1
1,5 mL de solution MnO4K à 1,0 x 10-3 mol.L-1
Pour le blanc on remplace la solution MNO4K par 1,5 mL d'eau distillée. Pour enregistrer, on place d'abord dans la cuve H2SO4 et H2C2O4 ; et on déclenche l'acquisition au moment où on verse la solution MnO4K.
2- Détermination de la longueur d'onde donnant l'absorbance maximale :
On fait le zéro en plaçant dans la cuve de l'eau distillée et on enregistre ensuite (avec les logiciels Synchrochim et Synchronie) le spectre d'absorbance A(l ) (voir page 3) entre 334 nm et 900 nm avec une solution MnO4K de concentration C = 2,5 x 10-4 mol.L-1
Sur cette courbe on relève un maximum d'absorbance dans le visible, Amax = 0,65 pour l = 523 nm ; et on calcule le coefficient k, pour cette espèce colorée, cette longueur d'onde et cette largeur de cuve :
k = [MnO4-] / A = 2,5 x 10-4 / 0,65 = 3,85 x 10-4 mol.L-1
3- Tracé des courbes cinétiques :
3-1 Courbes A(t) :
On fait deux acquisitions (avec les logiciels Synchrochim et Synchronie) programmées sur 250 s avec l = 523 nm :
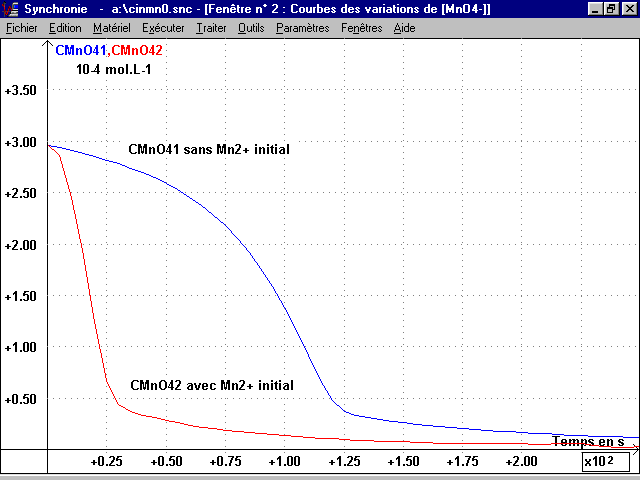
3-2 Courbes [MnO4-](t)] :
La feuille de calcul de Synchronie donne et on fait tracer dans les deux cas en fonction du temps du spectrophotomètre (temps) (voir page 3 , courbes CMnO41 et CMnO42) :
CMnO4 =[MnO4-](t) = k x A(t) = 3,85 x 10-4 x A(t) mol.L-1
en écrivant,
CMnO4 = 3,85*ABS {10-4 mol.L-1}
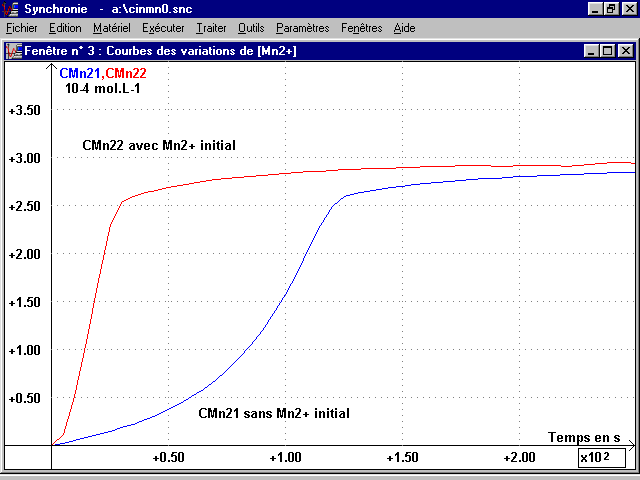
3-3 Courbes [Mn2+](t) :
La feuille de calcul de Synchronie donne et on fait tracer dans les deux cas en fonction du temps du spectrophotomètre (temps) (voir page 4, courbes CMn21 et CMn22) :
CMn2 = [Mn2+](t) = [MnO4-]0 - [MnO4-](t)
en écrivant,
CMn2 = max(CMnO4) - CMnO4 {10-4 mol.L-1}
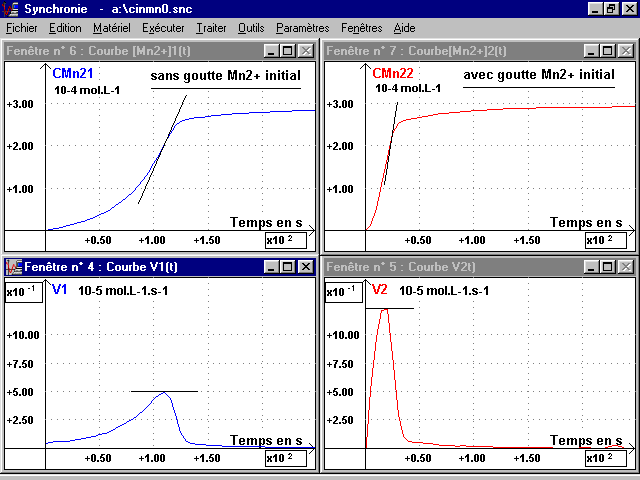
3-4 Courbes des vitesses volumiques (formation Mn2+ et disparition MnO4-) :
La feuille de calcul de Synchronie on fait tracer dans les deux cas en fonction du temps du spectrophotomètre (temps) (voir page 4 , courbes V1 et V2) :
:
V = dérivée [Mn2+](t)= - dérivée [MnO4-](t)
en écrivant,
V = deriv(CMn2,temps)*10 {10-5 mol.L-1.s-1}
4- Interprétation :
4-1 Mise en évidence de l'autocatalyse par Mn2+ :
Le rapprochement des courbes des deux expériences montre un évolution nettement plus rapide avec la goutte apportant Mn2+, catalyseur et aussi produit de cette réaction.
4-2 Variations de la vitesse volumique :
Cette vitesse dépend ici de deux facteurs cinétiques influant en sens inverses : la concentration des réactifs décroissant avec le temps et faisant décroître la vitesse ; la concentration de Mn2+ (produit et catalyseur de la réaction) croissante avec le temps et. faisant croître la vitesse.
Les courbes V(t) montrent : le deuxième facteur est d'abord prépondérant, avec la vitesse croissante ; ce qui entraîne la décroissance rapide de la concentration des réactifs et rend ensuite le premier prépondérant, avec la vitesse décroissante jusqu'à zéro.
On remarque que le maximum de la vitesse correspond à un instant où la courbe [Mn2+](t) présente un point d'inflexion. Ce maximum est atteint plus rapidement (20 s) et il est plus élevé (1,23 x 10-5mol.L-1.s-1) pour V2 que pour V1 (110 s et 0,49 x 10-5mol.L-1.s-1). Mais à cet instant, la concentration en Mn2+ est pratiquement la même dans les deux cas (" 2 x 10-4 mol.L-1 ).
Remarque :
On note la différence avec une réaction non autocatalytique où la vitesse ne dépend que de la concentration des réactifs et est toujours décroissante.

_________________________________________________________
© Administrateur Sciences-Physiques. Contact :
Alain.Choyeau@ac-bordeaux.fr© Rectorat de Bordeaux. Contact :
CATICE@ac-bordeaux.fr