
Etude de l'avancement d'une réaction avec l'ordinateur
Par Denis Gauthier, Lycée Bernard Palissy, 47000 Agen
1- Précisions sur la notion d'avancement :
1-1 Définition :
Au cours d'une réaction d'équation bilan générale,
a
A + b B ® g C + d Dla relation suivante, entre quantité de matière et coefficient stoechiométrique, est vérifiée à chaque instant :
nAdisparu / a = nBdisparu / b = nCformé / g = nDformé / d = x mol
Cette quantité de matière x varie à partir de 0 jusqu'à une valeur maximale xm : à chaque instant elle caractérise l'évolution de la réaction et est appelée avancement de la réaction.
Remarque :
Si un des corps a un coefficient stoechiométrique égal à 1, l'avancement représente alors la quantité disparue de ce corps pour un réactif ou la quantité formée de ce corps pour un produit.
1-2 Utilisation dans un bilan de matière :
* La réaction générale précédente est réalisée avec une quantité de matière initiale a pour A et b pour B. Les quantités présentes des corps du système réactionnel sont indiquées dans un tableau
|
|
avancement (mol) |
nA (mol) |
nB (mol) |
nC (mol) |
nD (mol) |
|
état initial |
0 |
a |
b |
0 |
0 |
|
état en cours |
x |
a - a x |
b - b x |
g x |
d x |
On remarque :
vitesse disparition A = - dnA / dt = a . dx / dt ; vitesse disparition B = - dnB / dt = b . dx / dt ;
vitesse formation C = dnC / dt = g . dx / dt ; vitesse formation D = dnD / dt = d . dx / dt
La connaissance de dx / dt permet de calculer les vitesses de tous les corps de la réaction.
* La réaction évolue jusqu'à l'épuisement d'au moins un réactif, où l'avancement atteint sa valeur maximale xm :
Le réactif limitant est donc associé à la plus petite valeur des rapports, a / a et b / b . Le connaissant ainsi, on peut alors ajouter l'état final correspondant dans le tableau précédent.
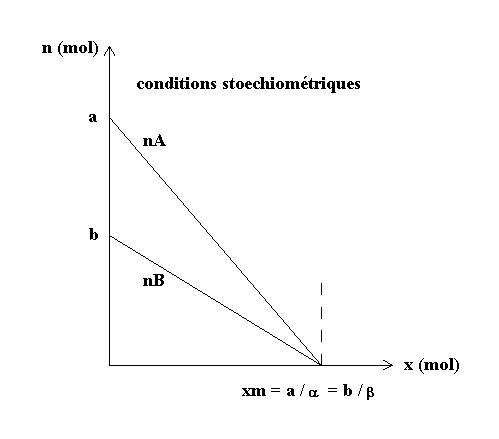
1-3 Tracé des courbes n(x) :
Courbes limitées aux réactifs.
* A réactif limitant :

* B réactif limitant :

* Conditions stoechiométriques :
2- Etude avec l'ordinateur :
Objectifs : pour une réaction donnée et des quantités de réactifs variables, obtenir à chaque fois le tracé des courbes n(x) et le tableau de bilan de matière.
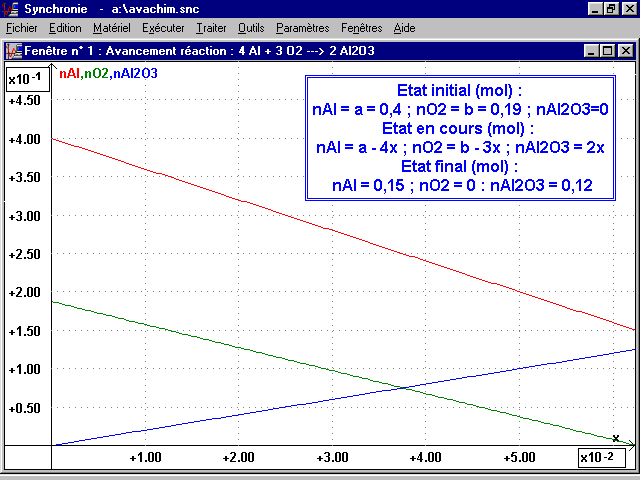
Cette étude peut-être faite avec tout tableur et notamment avec EXCEL. La feuille de calcul de SYNCHRONIE permet de la faire très facilement avec une rédaction identique à celle d'un exercice habituel. Exemple choisi, la combustion de l'aluminium dans le dioxygène.
2-1 Rédaction de la feuille de calcul :
Dans Paramètre ® Acquisition ; nombre de points 200 (fixe le nombre de valeurs attribuées à x par une rampe de 0 à xm).
Dans Traitement ® Feuille de calcul, ou calcul en bas à gauche dans la barre de tache de SYNCHRONIE.
On rédige ligne par ligne (un calcul par ligne), les mots entre { } donnent la signification du calcul demandé, voir copie d'écran page suivante.

2-2 Tracé des courbes n(x) :
Paramètres ® Courbes : nAl puis nO2 puis nAl2O3, trait continu, couleur au choix dans fenêtre 1.
®
Fenêtre 1 ; abscisse x , échelle en X basée sur x ; échelle en Y, manuelle entre 0 et a (ou b), échelle adaptée ensuite.Valider par OK et éventuellement adapter l'échelle en Y automatiquement avec l'étoile de la barre d'outil ou en changeant sa valeur maximale dans Paramètres ® Fenêtre.
2-3 Tableau du bilan de matière :
A partir de la fenêtre 1, dans la barre d'outil on active T et on tape :
Etat initial :
nAl = a = {a} (par ajouter variable numérique scalaire) ; nO2 = b = {b} (idem) ; nAl2O3 = 0
Etat en cours :
nAl = a - 4x ; nO2 = b -3x ; nAl2O3 = 2x
Etat final :
nAl = {nAlfinal} (idem) ; nO2 = {nO2final} (idem) ; nAl2O3 = {nAl2O3final} (idem)
On choisit la couleur du texte, du fond, l'encadrement et on valide : le tableau apparait dans la fenêtre 1 où on peut le positionner. En faisant varier les valeurs de m et de V, on se place dans les trois cas possibles, voir copies d'écran pages suivantes.


_________________________________________________________
© Administrateur Sciences-Physiques. Contact :
Alain.Choyeau@ac-bordeaux.fr© Rectorat de Bordeaux. Contact :
CATICE@ac-bordeaux.fr