Influence de la concentration initiale des réactifs dans l'oxydation de I- par H2O2
Par Denis Gauthier, Lycée Bernard Palissy, 47000 Agen
1- Principe de l'étude expérimentale :
1-1 Solutions utilisées :
Solution H2O2 à 6,0 x 10-3 mol.L-1 ; solution KI à 2,5 x 10-1 mol.L-1 ; solution H2 SO4 à 1 mol.L-1
Dans chaque cas, H2O2 est le réactif limitant et par suite [I2]final = [H2O2]initial connu.
1-2 Enregistrement des courbes d'absorbance à l'ordinateur :
L'évolution de la réaction est suivie au spectrophotomètre avec ordinateur, équipé de Synchrochim et Synchronie, qui enregistre la courbe A(t) des variations de l'absorbance. Pour ne pas saturer le spectrophotomètre en fin de réaction, on utilise une longueur d'onde l = 450 nm (pour I2 en présence de I-, l max " 350 nm). L'enregistrement est fait sur 500 s.
La réaction étant terminée en fin du premier enregistrement, on peut calculer la valeur de la constante : k = [I2]final / Afinal = [H2O2]initial / A final " 1,0 x 10-3 mol.L-1
Cette constante permet, avec la feuille de calcul, d'obtenir les courbes C = [I2](t) à partir de A(t) C = k*A
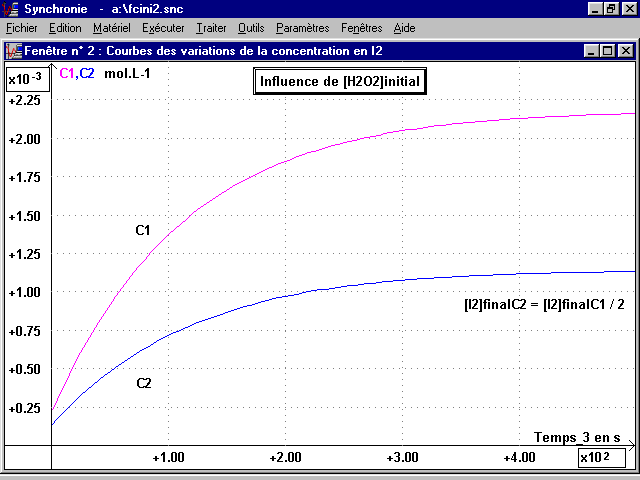
2- Influence de [H2O2]initial :
On compare les courbes[I2](t) pour une même concentration initiale en I- et une concentration initiale en H2O2 différente.
2-1 Courbes [I2](t) :
On fait deux enregistrements donnant C1 et C2 (voir page suivante), en plaçant successivement dans la cuve de 5 mL :
* 1,5 mL H2O2 (6,0 x 10-3 mol.L-1) + 1,5 mL KI (2,5 x 10-1 mol.L-1)+ 1 mL H2 SO4 (1 mol.L-1)
avec :
[H2O2]initial = 6,0 x 10-3 x (1,5 / 5) = 2,25 x 10-3 mol.L-1
[I-]initial = 2,5 x 10-1 x (1,5 / 5) = 0,94 x 10-1 mol.L-1
* 0,75 mL H2O2 (6,0 x 10-3 mol.L-1) + 0,75 mL eau distillée + 1,5 mL KI (2,5 x 10-1 mol.L-1)+ 1 mL H2 SO4 (1 mol.L-1) avec :
[H2O2]initial = (2,25 x 10-3) / 2 = 1,13 x 10-3 mol.L-1
[I-]initial = 2,5 x 10-1 x (1,5 / 5) = 0,94 x 10-1 mol.L-1
Remarque :
A t = 0 sur ces courbes, la concentration de I2 (produit) n'est pas nulle car la réaction a commencé quelques secondes plutôt au moment du mélange, avant de placer la cuve dans le spectrophotomètre.
2-2 Interprétation :
La vitesse initiale de réaction, indiquée par la pente de la tangente à t = 0, est plus grande pour C1 que pour C2 : elle varie dans le même sens que la concentration initiale en H2O2.
En fin de réaction la concentration finale en I2 est moitié pour C2 (quantité initiale de réactif limitant divisée par 2).

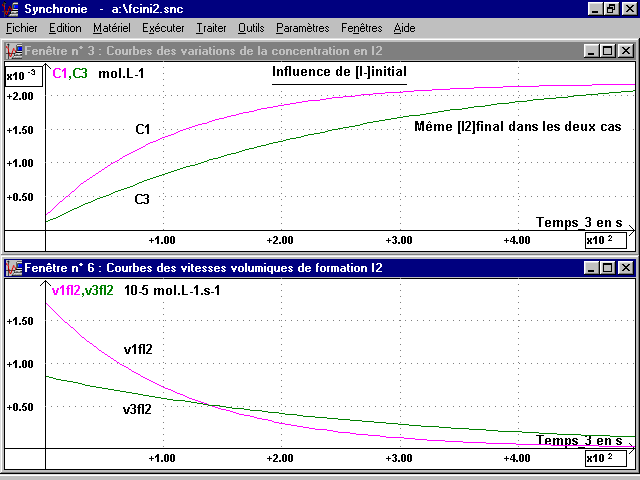
3- Influence de [I-]initial :
On compare les courbes[I2](t) pour une même concentration initiale en H2O2 et une concentration initiale en I- différente.
2-1 Courbes [I2](t) :
* On fait un troisième enregistrement donnant C3 (voir page suivante), en plaçant dans la cuve de 5 mL :
1,5 mL H2O2 (6,0 x 10-3 mol.L-1) + 0,75 mL KI (2,5 x 10-1 mol.L-1) + 0,75 mL eau distillée + 1 mL H2 SO4 (1 mol.L-1)
avec :
[H2O2]initial = 6,0 x 10-3 x (1,5 / 5) = 2,25 x 10-3 mol.L-1
[I-]initial = (0,94 x 10-1) / 2 mol.L-1 = 0,47 x 10-1 mol.L-1
* En même temps que C3, on fait afficher dans la même fenêtre, C1 :
[H2O2]initial = 6,0 x 10-3 x (1,5 / 5) = 2,25 x 10-3 mol.L-1
[I-]initial = 2,5 x 10-1 x (1,5 / 5) = 0,94 x 10-1 mol.L-1
2-2 Interprétation :
La vitesse de réaction, indiquée par la pente de la tangente à t = 0, est au début plus grande pour C1 que pour C2 : elle varie dans le même sens que la concentration initiale en I-.
La limite atteinte est ici la même (même quantité de réactif limitant) mais elle est plus vite atteinte avec C1 qu'avec C3.

4- Conclusion :
Ces résultats se généralisent à chaque instant de la plupart des réactions chimiques :
les vitesses cinétiques varient dans le même sens que les concentrations de chaque réactif.
5- Courbes des vitesses volumiques de formation I2 :
En dérivant dans la feuille de calcul les courbes modélisées de C1, C2 et C3, (très bon résultat avec des polynômes de degré 6), on obtient les courbes des vitesses volumiques de formation I2. Les courbes des vitesses sont présentées associées aux courbes des concentrations pour les deux cas étudiés, Influence [H2O2]initial et Influence [I-]initial (voir page suivante).
On remarquera que pour cette réaction les vitesses sont toujours des fonctions décroissantes du temps. Ce résultat se généralise à la plupart des réactions où la concentration des réactifs est le seul facteur cinétique. Il illustre la conclusion du § 4 : ces vitesses varient dans le même sens que la concentration des réactifs, diminuant à mesure que la réaction se déroule.

_________________________________________________________
© Administrateur Sciences-Physiques. Contact :
Alain.Choyeau@ac-bordeaux.fr© Rectorat de Bordeaux. Contact :
CATICE@ac-bordeaux.fr