
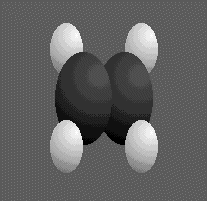
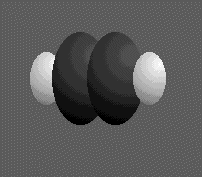
Les molécules en Terminales scientifiques
_______________________
Considérons successivement les modèles des molécules d'éthane ,d'éthène et d'éthyne .

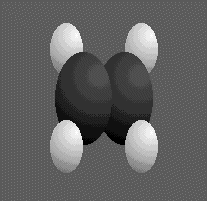
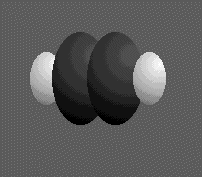
Nous remarquons que la géométrie des molécules dépend du type de liaison covalente C-C.L'éthane CH3-CH3 ne contenant qu'une simple liaison covalente est tridimensionnelle , l'éthène CH2=CH2 contenant une double liaison covalente est plane , tandis que l'éthyne CH
º CH contenant une triple liaison covalente est linéaire .Observons la molécule d'éthane de côté ,sachant que les radicaux méthyle CH3 peuvent tourner autour de la simple liaison covalente C-C .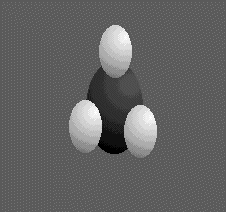

Une infinité de molécules existe en décalant les atomes d'hydrogène du groupe méthyle situé en avant-plan par rapport à ceux du groupe méthyle situé en arrière-plan .Chacune des dispositions constitue une
conformation .La conformation ci-dessus à droite est dite décalée , sinon à gauche elle est dite éclipsée .Une molécule d'alcane à cinq atomes de carbone peut avoir plusieurs conformations suivant les formes des différentes chaînes du carbone ,ainsi pour le pentane à gauche,le 2-méthylbutane au centre et le 2,2-diméthylpropane à droite .

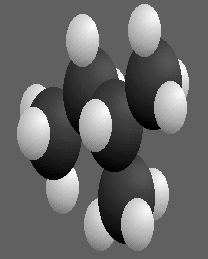
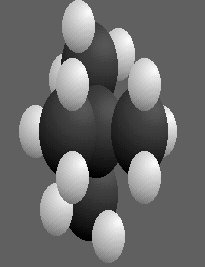
Pour la molécule de cyclohexane C6H12 ,la conformation est soit chaise ci-dessous à gauche soit bateau à droite .
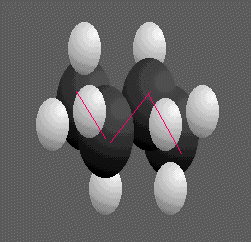
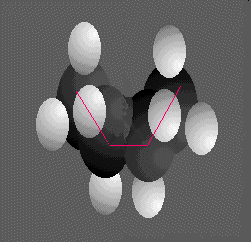
Un atome de carbone tétraèdrique lié à quatre atomes différents ou quatre groupements d'atomes différents est dit asymétrique.Il conduit à des molécules
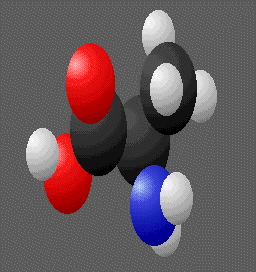
chirales , symétriques l'une de l'autre par rapport à un plan .Deux molécules chirales ne peuvent pas être superposées , elles se regardent comme dans un miroir .Par exemple ci-dessous deux molécules chirales d'alanine (acide 2-amino propanoïque ) .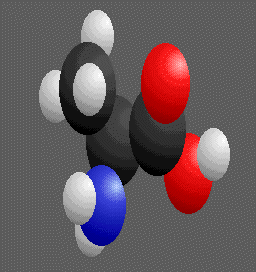
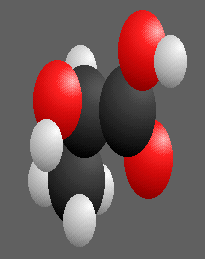
Ou encore les deux acides lactiques CH3-CHOH-COOH (acide 2-hydroxy propanoïque ) .
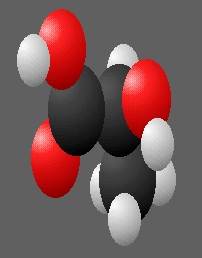
Visionnons quelques molécules connues du programme : à gauche l'acide salicylique,au centre l'acide acétylsalicylique ou
aspirine ,enfin à droite l'acide benzoique.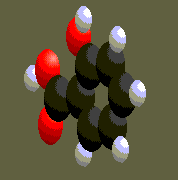
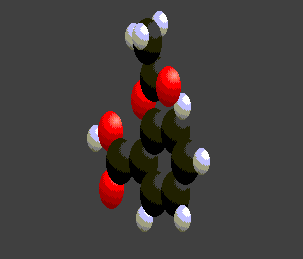
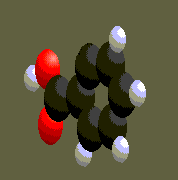
Si les images n'apparaissent pas , cliquez dessus avec le bouton gauche de la souris et rechargez les.
___________________________________________________________________________________________
© Administrateur Sciences-Physiques. Contact :
Alain.Choyeau@ac-bordeaux.fr© Rectorat de Bordeaux. Contact :
CATICE@ac-bordeaux.fr